Los gases suelen comportarse de manera ideal, siguiendo las leyes de los gases perfectos. Sin embargo, a medida que descendemos a temperaturas más frías y ascendemos a presiones más elevadas, este comportamiento ideal se desmorona, revelando la influencia de un actor invisible: las fuerzas intermoleculares.
Estas fuerzas, cual hilos invisibles entre las moléculas, se intensifican en ambientes fríos y densos, modificando drásticamente el comportamiento del gas. A presiones y temperaturas suficientemente bajas, estas fuerzas logran atrapar a las moléculas, uniéndolas lo suficiente como para que se condense el gas, dando paso al estado líquido.
Las fuerzas intermoleculares nacen de la distribución desigual de electrones dentro de las moléculas. Esta distribución, en constante cambio, genera regiones con cargas positivas y negativas, atrayendo o repeliendo a otras moléculas.
Un tipo importante de estas fuerzas son las fuerzas de Van der Waals, bautizadas en honor al físico holandés Johannes Diderik van der Waals. Estas fuerzas se subdividen en tres categorías:
-
Fuerzas de Keesom: Atracción entre dipolos permanentes, es decir, moléculas con una distribución permanente de carga positiva en un extremo y negativa en el otro.
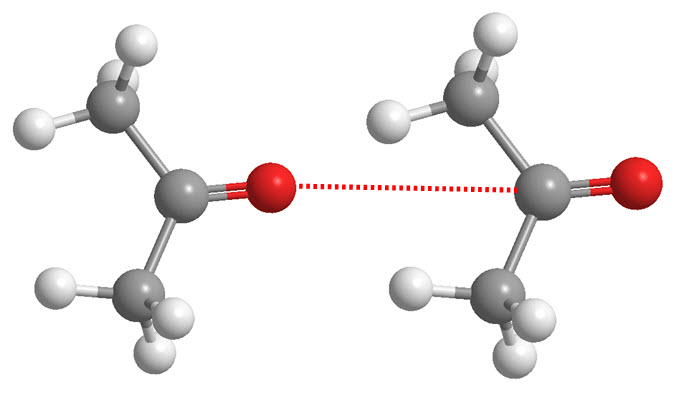
-
Fuerzas de Debye: Interacciones entre dipolos inducidos y permanentes. Un dipolo permanente puede inducir un dipolo temporal en una molécula cercana, generando atracción entre ambas.
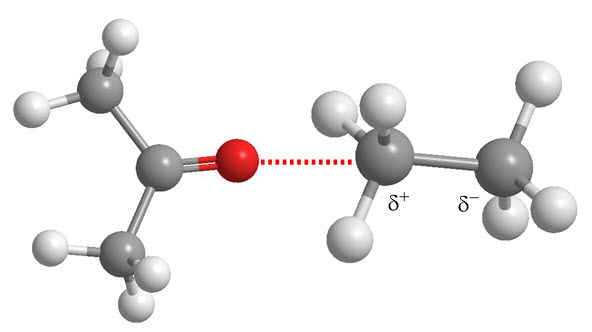
-
Fuerzas de dispersión de London: Atracciones débiles entre moléculas apolares. La distribución instantánea de electrones en una molécula apolar puede generar un dipolo temporal, que a su vez induce un dipolo temporal en una molécula vecina, creando una fuerza atractiva.
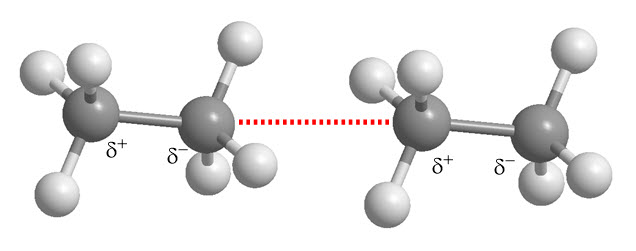
Helio: un caso especial
El helio, el gas noble más inerte, nos presenta un caso fascinante. A pesar de carecer de la capacidad de formar enlaces químicos estables, este elemento no se condensa a 0 K, como cabría esperar. Sin embargo, a 4 K y bajo 25 atmósferas de presión, cede a las fuerzas de Van der Waals, condensándose en líquido y solidificándose a 1 K.
Este comportamiento del helio resalta la importancia de las fuerzas intermoleculares, incluso en las sustancias más inertes. A temperaturas suficientemente bajas, estas débiles fuerzas logran superar la agitación térmica, uniendo a las moléculas de helio y dando lugar a su condensación.
Explorando las profundidades:
Las fuerzas intermoleculares no solo afectan la condensación de gases, sino que también determinan la forma y el comportamiento de la materia en general. Desde la estructura de los sólidos cristalinos hasta la cohesión de los líquidos, estas fuerzas invisibles juegan un papel fundamental en la configuración de nuestro mundo.
El estudio de las fuerzas intermoleculares nos adentra en un universo fascinante, donde las moléculas se unen y separan en una danza constante, dictada por la temperatura, la presión y la distribución de electrones.



