Los compuestos suelen presentar puntos de ebullición que siguen una tendencia predecible basada en su masa molecular. Sin embargo, algunos compuestos desafían esta lógica, mostrando puntos de ebullición mucho más altos de lo esperado. La clave para entender este enigma reside en un tipo especial de fuerza intermolecular: el enlace de hidrógeno.
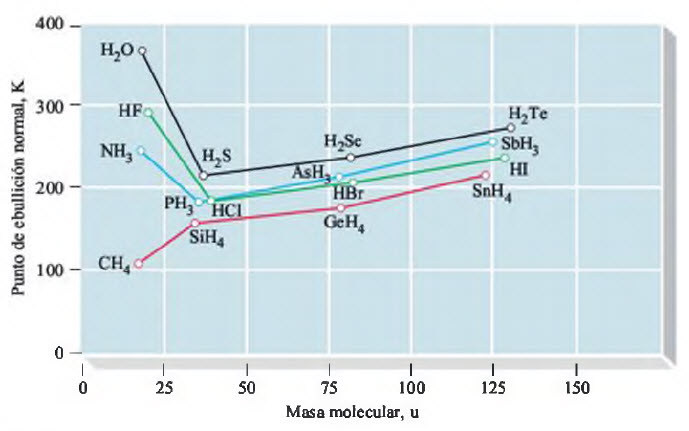
La Figura nos muestra el comportamiento anómalo de los hidruros (compuestos de hidrógeno) de los grupos 15, 16 y 17. A pesar de tener masas moleculares similares, sus puntos de ebullición son significativamente más altos que los de sus homólogos en los grupos 14. La razón de este comportamiento inusual se encuentra en la capacidad del hidrógeno para formar enlaces de hidrógeno.
El enlace de hidrógeno no es un enlace químico convencional como un enlace covalente, sino una atracción electrostática más bien fuerte. En este tipo de enlace, un átomo de hidrógeno, unido covalentemente a un átomo altamente electronegativo (como F, O o N), es atraído simultáneamente por un par de electrones libres de otro átomo electronegativo de una molécula vecina.
Imagina que el átomo de hidrógeno actúa como un puente entre dos átomos electronegativos, uniéndolos en una danza molecular. La Figura 12.6 ilustra este fenómeno para el fluoruro de hidrógeno (HF).
Lo que hace que los enlaces de hidrógeno sean tan especiales es su relativa fuerza. A pesar de no ser enlaces covalentes, su energía de enlace oscila entre 15 y 40 kJ/mol, lo que los convierte en fuerzas intermoleculares significativamente más fuertes que otras como las fuerzas de Van der Waals.
Los enlaces de hidrógeno tienen un profundo impacto en las propiedades de la materia, especialmente en líquidos y sólidos. Son responsables de la alta cohesión del agua, lo que le permite formar estructuras complejas como el hielo. También juegan un papel crucial en la estructura de las proteínas y los ácidos nucleicos, moléculas esenciales para la vida.
El estudio de los enlaces de hidrógeno nos abre un universo de posibilidades en la comprensión de la química y la biología. Su influencia en la estructura y propiedades de la materia nos permite comprender mejor el comportamiento de los sistemas biológicos y diseñar nuevos materiales con propiedades específicas.



