Imagina un vaso de precipitados con agua. Si lo dejamos destapado, el agua se evapora hasta desaparecer. Pero si lo colocamos dentro de un recipiente cerrado, algo distinto sucede: vapor y líquido coexisten en un baile constante.
En este recipiente cerrado, la vaporización (el agua que se convierte en vapor) y la condensación (el vapor que se convierte en agua) ocurren al mismo tiempo. Llega un momento en que la cantidad de vapor se estabiliza, ni aumenta ni disminuye. ¡Es el equilibrio dinámico!
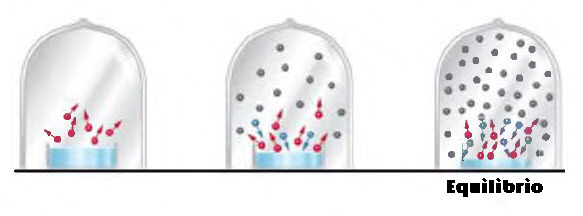
El equilibrio dinámico significa que dos procesos opuestos ocurren a la misma velocidad, como si se compensaran. En este caso, la cantidad de vapor que se produce es igual a la cantidad que se condensa.
La presión que ejerce el vapor en este equilibrio se llama presión de vapor. Los líquidos con presiones de vapor altas a temperatura ambiente son volátiles (como el éter dietílico o la acetona), mientras que los que tienen presiones de vapor bajas son no volátiles (como el agua o el mercurio).
La volatilidad depende de la fuerza de las fuerzas intermoleculares entre las moléculas del líquido. Cuanto más débiles sean estas fuerzas, más fácil se evapora el líquido y mayor será su presión de vapor.
En resumen:
- La presión de vapor es la presión que ejerce el vapor en equilibrio con su líquido.
- Los líquidos volátiles tienen presiones de vapor altas, mientras que los no volátiles las tienen bajas.
- La volatilidad depende de la fuerza de las fuerzas intermoleculares.
- La presión de vapor solo depende del tipo de líquido y la temperatura, no de la cantidad de líquido o vapor.
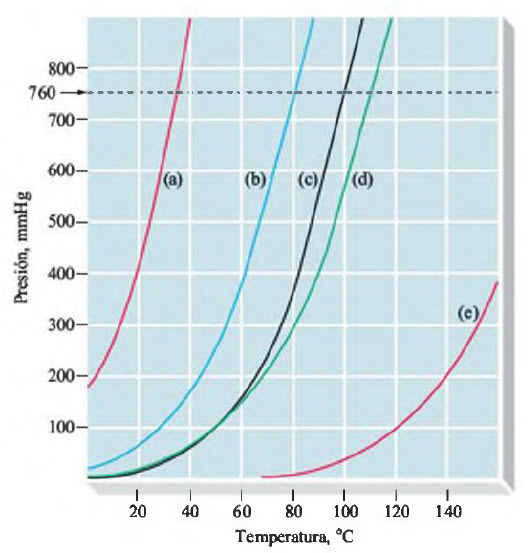
Las curvas de presión de vapor muestran cómo cambia la presión de vapor con la temperatura.