
Imagina un sólido cristalino, como un castillo de hielo. A medida que lo calentamos, los átomos que lo componen comienzan a vibrar con más energía, como si bailaran cada vez más rápido. Llega un momento en que este baile se vuelve tan intenso que el orden del castillo se rompe: los átomos se deslizan unos sobre otros y el sólido se derrite, convirtiéndose en un líquido.
Este proceso se llama fusión, y la temperatura a la que ocurre es el punto de fusión. Es como si el calor le diera a los átomos la fuerza suficiente para escapar de su lugar fijo y fluir libremente.
El proceso inverso, la solidificación o congelación, ocurre cuando el líquido se enfría y los átomos vuelven a encontrarse y ordenarse en la estructura cristalina. La temperatura de congelación es la misma que la de fusión.
- La fusión es el cambio de un sólido a un líquido.
- El punto de fusión es la temperatura a la que ocurre la fusión.
- La congelación es el cambio de un líquido a un sólido.
- El punto de congelación es la temperatura a la que ocurre la congelación.
- El punto de fusión y el punto de congelación de una sustancia son la misma temperatura.
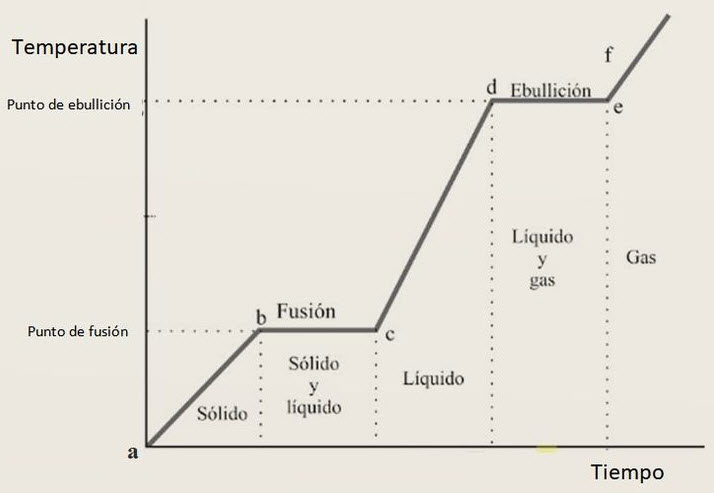
Cuando calentamos una mezcla de sólido y líquido en equilibrio, la temperatura se mantiene constante mientras el sólido se funde. Toda la energía se utiliza para romper el orden del cristal, no para aumentar la temperatura. Solo cuando todo el sólido se ha fundido, la temperatura comienza a subir.
Lo mismo ocurre al contrario: si enfriamos una mezcla de sólido y líquido en equilibrio, la temperatura se mantiene constante mientras el líquido se solidifica. La energía se libera al formarse el cristal, manteniendo la temperatura estable.
La cantidad de calor necesaria para fundir un mol de sólido se llama entalpía de fusión (ΔHfus).
Un ejemplo conocido:
El agua es un caso familiar de fusión y congelación. Se congela a 0 °C y se funde a la misma temperatura. La entalpía de fusión del agua es de 6,01 kJ/mol, lo que significa que se necesita esta cantidad de energía para fundir un mol de hielo y convertirlo en agua líquida.
Curvas de enfriamiento:
Para determinar el punto de solidificación de un líquido, podemos observar su curva de enfriamiento. En esta gráfica, la temperatura se representa en función del tiempo. Cuando el líquido comienza a solidificarse, la temperatura se mantiene constante hasta que todo el líquido se ha convertido en sólido. Luego, la temperatura continúa disminuyendo a medida que el sólido se enfría.
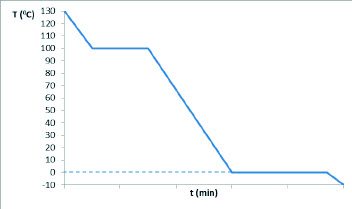
La fusión, el punto de fusión, la congelación, el punto de congelación, la entalpía de fusión y las curvas de enfriamiento son conceptos fundamentales para comprender el comportamiento de los sólidos y líquidos ante los cambios de temperatura. Estos fenómenos tienen numerosas aplicaciones en diversos campos, desde la industria alimentaria hasta la ciencia de materiales.
Curvas de calentamiento:
Comenzamos con un sólido y lo calentamos. A medida que la temperatura aumenta, los átomos se agitan y la estructura cristalina se rompe. Llega un momento en que el sólido se derrite, convirtiéndose en un líquido.
En este caso inverso, la temperatura se mantiene constante durante la fusión. Toda la energía se utiliza para desordenar el cristal, no para aumentar la temperatura.
La gráfica que representa la temperatura en función del tiempo durante este proceso se llama curva de calentamiento. En general, es similar a la curva de enfriamiento pero "al revés", como si la hubiéramos girado de izquierda a derecha.
A veces, la curva de enfriamiento que observamos en un experimento no es exactamente como la línea continua de la Figura. La temperatura puede disminuir por debajo del punto de congelación sin que se forme un sólido. Esto se llama subenfriamiento.
Para que el líquido se convierta en un sólido cristalino en el punto de congelación, necesita pequeñas partículas (como polvo en suspensión) que sirvan como base para la formación de cristales. Si el líquido tiene pocas de estas partículas, puede subenfriarse durante un tiempo antes de solidificarse.
Sin embargo, cuando el líquido subenfriado comienza a solidificarse, la temperatura sube de nuevo al punto de congelación normal mientras se completa la solidificación.
En la curva de enfriamiento, el subenfriamiento se manifiesta como una ligera caída de la temperatura justo antes del tramo horizontal de la línea recta.
En resumen:
- La curva de calentamiento es la representación de la temperatura en función del tiempo durante la fusión.
- El subenfriamiento es el fenómeno por el cual la temperatura de un líquido desciende por debajo del punto de congelación sin que se solidifique.
- El subenfriamiento se produce cuando el líquido no tiene suficientes partículas sobre las que se puedan formar los cristales.
- La curva de enfriamiento muestra una ligera caída de la temperatura justo antes del tramo horizontal si hay subenfriamiento.



