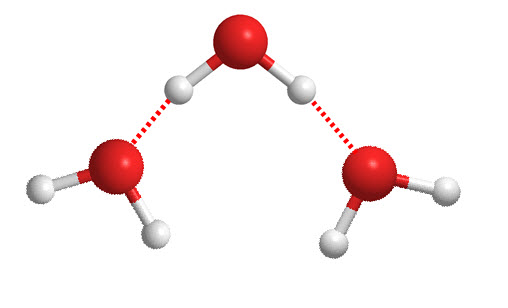
Las fuerzas de Van der Waals, aunque débiles, juegan un papel fundamental en el comportamiento de gases, líquidos y sólidos. Para comprender su relevancia, consideremos los siguientes puntos:
Fuerzas de dispersión (de London):
- Presentes en todas las moléculas.
- Implican el movimiento de todos los electrones, aumentando con la masa molecular.
- Dependen de la forma de la molécula.
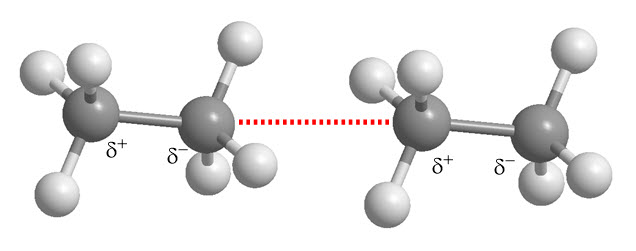
Fuerzas dipolares:
- Asociadas a dipolos permanentes (moléculas polares).
- Resultan del desplazamiento de pares de electrones en enlaces.
- Se suman a las fuerzas de dispersión en moléculas polares.
- Afectan propiedades como punto de fusión, ebullición y entalpia de vaporización.
- En moléculas de masas similares, las dipolares pueden causar grandes diferencias en estas propiedades.
- En moléculas de masas muy diferentes, las dispersión suelen ser más importantes que las dipolares.
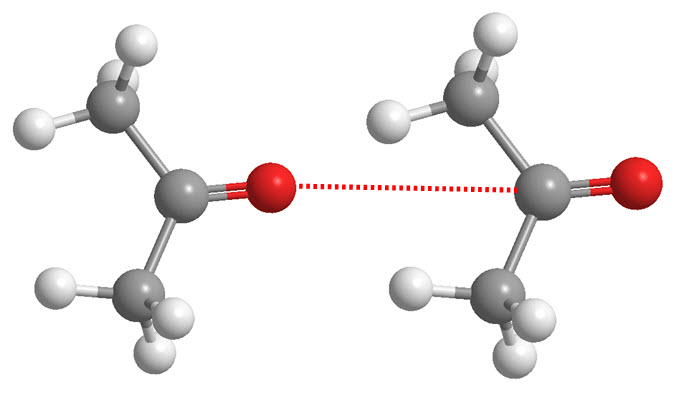
Conclusiones:
- Las fuerzas de Van der Waals, aunque débiles, influyen significativamente en el comportamiento de la materia.
- La polaridad y la masa molecular son factores clave para determinar la fuerza de las interacciones de Van der Waals.
- Las fuerzas de dispersión son generalmente más importantes que las fuerzas dipolares, especialmente en moléculas de masas muy diferentes.
Análisis de algunos casos:
- HCl y F2: Masas moleculares similares, pero HCl es polar por lo que presenta fuerzas intermoleculares más intensas y un mayor punto de ebullición.
- HCl, HBr y HI: Aumento de masa molecular y fuerzas de dispersión hacen que los puntos de ebulición sigan el orden HI>HBr>HCl.
- HCl y HBr: Más polares que HI, pero no compensan el efecto de la masa molecular. En este caso, las fuerzas de Van der Waals están dominadas por las fuerzas de dispersión.
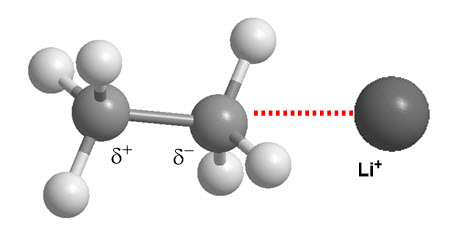
- Fuerzas de dispersión de London. Dipolo instantaneo - dipolo inducido

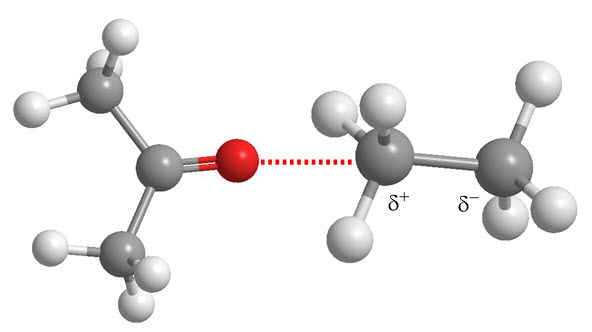
- Dipolo permanente - dipolo inducido
- Dipolo permanente - dipolo permanente

- Ion - dipolo permanente
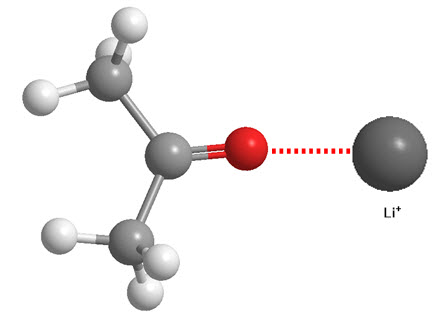
- Ion - dipolo inducido
- Enlaces de hidrógeno